毒にも栄養にもなる鉄のおはなし
今回は横浜の中村さん。久しぶりの横浜。なんだかきちんとスライドとか準備されていて、とてもありがたいのだけど、これまでゆるーくお話を伺ってきたので、ちょっと腰が引け……。あ、お茶。烏龍茶ですか。ありがとうございます。では、さっそく……。(聞き手:薬師寺秀樹)
実は微量じゃない体内の鉄
中村さんのお仕事って、ざっくりと構造生物学タンパク質などの分子構造から、その機能を明らかにする学問。X線結晶構造解析やNMRなどを使うことが多いが、最近はクライオ電子顕微鏡なども活躍している。(後述あります。)という分野で僕は理解をしているのですが。
いえ、所属しているチームは構造生物学を研究しているんですが、僕自身は遺伝学とか生化学とか、そういう研究が基本なんです。だから構造生物学者ではなく、構造を見たい人、なんです。でも、困ったことに、自分で構造を決められない人なんです(笑)。だから僕のことは、鉄の生物学者と思ってください。
そうなんですね。どうして鉄をテーマに?
鉄というのは、細菌を含めて、ほとんどの生物で必要とされているんです。
僕らの身体を構成する元素というのは、主なものを挙げると、酸素、炭素、水素、窒素、リン、硫黄とかが思い浮かびますよね。鉄はあまり量は多くないんだけども、すごく大事な働きをしているのは間違いない。それは一般の方もたぶん理解をしてくれると思うんです。鉄不足だと貧血になっちゃっう、とか。
鉄って、細菌とヒト両方に大事なんですが、過ぎたるは及ばざるがごとしで、毒になることもあります。その際、解毒するのにどういう仕組みでタンパク質が働いているのかなというところを自分のテーマにしています。
早速ですけど、地球で一番多い元素は何だと思いますか?
炭素とかケイ素とかですかね?
いい線いってます。
(テーマが鉄なら……)まさかの鉄? コア地球の中心部。鉄、ニッケルが主成分。液体だと考えられていて、このコアの中で起こる対流が地球の磁場を作っていると言われている。にあるからか!
そうです。鉄なんです。僕らの日常生活で鉄というのは身の回りにあって、現代社会になくてはならない金属なんですけど、実は地球丸ごとで見ると重量的に一番多くを占めています。30%くらい。
それでは、体重が60kgくらいの人だったら、身体の中に何グラムくらい鉄があると思いますか?
うーん。さっぱりイメージがわかないです……。
実は、5gくらいあるんです。
(多いんだか少ないんだか……)
先ほども言ったようにほとんどの生物にとって鉄って欠かせません。例外的に鉄がいらない生物が見つかったという論文があるんですけど、僕は2報しか見たことないですね。
鉄はほとんどの生物で利用されていて、ヘム鉄イオンを中心に、ポルフィリンという環状の有機化合物が取り囲んだ錯体のこと。の鉄とヘムでない鉄(非ヘム鉄)という形で存在しています。ポルフィリン環というのがあって、金属を中に閉じ込める力があるのでそこに鉄をスポッとはめこんで仕事をさせています。これがヘムの鉄です。
輪っかになっているのがポルフィリン環で、この環の中に鉄が入ってヘムになるんですね。
そうです、その通りです。血液のヘモグロビンのヘムです。

また、ミトコンドリアの中にシトクロムという色素タンパク質がありますが、これもやはりヘムを含んでいて、そこで、電子を受け取って、ATP合成をするための発電所のような働きをしている。鉄がこのポルフィリンの中にいて、電子をもらって、酸素に渡してということをしながら、エネルギーをつくり出しているというふうに理解してもらったらいいです。
この輪っかの部分はプロトポルフィリンというのですが、似たものが他にあります。ちょっと形が違うけど、鉄の代わりにマグネシウムが入っているものが有名なクロロフィルです。
それでは、人間の体内にだいたい5Lくらいの血液があるんですが、その中に赤血球が何個あるでしょうか?
血液の中の水を取り除いたら、ほとんど赤血球だと思うんですよね……。うーん。
20兆個くらいあります。
めっちゃあるじゃないですか。あれ、人間の細胞って40兆個諸説あります。ちょっと前までは60兆とか80兆とか言われていたりして、最近38〜40兆くらいというのが主流になってきました。くらいですよね?半分もあるってことですか?
全身の細胞一個一個に酸素を送り届けないと僕らは生きていけないんです。だから、そのくらい赤血球がいっぱいないと生きていけないってことなんですよ。赤血球に大体2.5gくらいの鉄があるそうです。
で、毎日1~2mgくらいは排泄されて体外に出ちゃいます。
その分は口から摂取しないといけない、と。
そう。僕らは毎日食事で排泄されるものと同量の鉄を取らないと貧血になっちゃうということです。
で、単に食べればいいかというと、そうは問屋がおろさないんです。吸収率を考えなきゃいけないから。
形によって吸収率が違うんですか?
ほうれん草みたいな植物の鉄というのは非ヘム鉄が多いんです。これは吸収率が悪い。
ヘム鉄をそのまま取ったほうがいいってことですか?
そうなんです。例えば、ほうれん草だと吸収率が5%くらいなんです。だから、菜食主義者がほうれん草だけから鉄分を取ろうと思ったならば、1日に2kg食べればいい。それは大変なので、サプリで補うこともできます。最近はヘム鉄って書いているものも見かけますね。ヘムの吸収率は20%ほどで、ヘムが豊富な赤身の肉や魚なら、50gほど食べれば十分という計算になります。
でも、ビタミンCは鉄の吸収を高めるといわれているし、タンニンは吸収を阻害すると言われています。ですから僕らは普通においしいものをバランス良く食べていれば、それで十分だと思うんですけどね。
細胞に鉄を入れたり出したり
そういうわけで、これからいよいよ生物の話になるんですけど。
(ここまでが前置きだったのか……)
生物を作っている細胞は、細胞膜という袋があってその中に水が入っているようなもんだと思ってください。その膜の内と外でいろいろやりとりをしています。物質とかエネルギーとか。でも、細胞膜があるので、ボーっとしているだけだと出入りは起こりません。
ヘム鉄や非ヘム鉄はどんなふうにして身体の中に取り込まれているかという問題には、昔からいろいろな研究者が挑戦してきました。こういう物質を細胞の中に取り込むためには、細胞膜に特別なタンパク質がないといけないんです。
細胞膜を貫通するトランスポーターとか。
そうです。トランスポーターです、まさに。
ヒトでは消化管の十二指腸で鉄の吸収が頻繁に起こっていることがわかっています。1997年に2価の非ヘム鉄を取り込むトランスポーターが発見され、その後、ついにヘムを取り込むトランスポーターも見つかってきました。
「見つかってきました」ってことは、比較的最近の話なんですか?
2005年なので15年前ですね。
例えばレバーを食べたときには、まだヘモグロビンという大きなタンパク分子の状態です。それを分解していって、ヘムのところだけが離脱して、そのヘムがこのトランスポーターを介して細胞の中に入っていく、って感じです。そうしてようやく細胞が使える状態になる。
それでいよいよ僕の研究になります。ここまではイントロが長かったですよね。
(まだイントロだったのか……。)
これまでの僕の話を聞くとやっぱりヘムって大事だなと思ったでしょう。でもこれからはヒトや細菌にとって、ヘムも毒だよという話をします。
これは僕の研究じゃないんですけども、鉄を動物培養細胞にたくさん与えた時、クエン酸と結合している鉄よりも、ヘムの鉄のほうが細胞をいっぱい殺してしまうという報告があります。ヘムの方が度が過ぎると毒になるというデータです。
細胞は普段、このようにヘムの鉄が毒にならないように、度が過ぎた分は解毒していると考えられています。問題は、どうやってその毒を解毒するのかということです。考えられる方法は大きく3つあります。
細菌を例にして説明しますね。
1つ目の可能性は、欲しい分だけ取って、余計な分は取り込まないという防ぎ方。グラム陰性の細菌ってご存じですか? 例えば大腸菌とか、緑膿菌とかです。グラム陰性細菌というのは、細胞膜の他に外膜という別の脂質膜を持っているんです。この外膜がバリアになるんです。これらの細菌は自分が欲しい分だけ取り込んで、余計なものは外膜がバリアになって弾き返している。
2つ目は、細胞の中に入っちゃったヘムを、分解するという解毒の方式。壊せばいいよね、毒でも。そういうやり方。
それから3つ目。過剰に入ってきたヘムは外にまた出しちゃうという解毒方法。
今日の主役はこの3つ目の話です。
病原菌はヒトに感染して増殖する際に、ヒトのヘムを奪い取ります。そして、細菌が血中で増殖すると敗血症という重篤な病気を引き起こすことがあります。細菌がヘムを菌体内に取り込むトランスポーターは既に研究されていて、立体構造も決定されました。しかし、血中でヘムを奪い取る際には有毒であるヘムに細菌が過剰に曝されてしまいます。黄色ブドウ球菌やジフテリア菌のようなグラム陽性菌は外膜を持たないので大腸菌とは違い、余計なヘムの流入を許してしまいます。では、どうやってヘムの毒から身を守っているのか?2007年にその答えが見つかりました。黄色ブドウ球菌にヘムを解毒するトランスポーターが存在するということが遺伝子レベルでわかってきたのです。
このタンパク質は、遺伝子配列はわかっている(つまり、アミノ酸配列はわかっている)んだけれども、実際タンパク質を手に取った研究者はまだいないという状況で、僕はこのジフテリア菌のヘムのトランスポーターを試料として研究を始めました。
というわけで、鉄は重要なんだけど、それでいて、毒という意外性もあるということを知って研究を始めたんです。鉄を栄養にするという研究ももちろんあるんですけど、意外性のあるほうが楽しいかなと思って(笑)。ヘム解毒の研究者はそんなにいないです。例えば、タンパク質を扱っている人はいないんです。遺伝子を扱っている人だってそんなにいない。アメリカに二つか三つくらいの研究室じゃないかな。あとフランスに一つか二つくらいかな。それくらいだと思います。
ヘムが毒にもなることの証明とその解毒方法
とにかくまずは、「ヘムが毒になる」というのを自分の目で見たいと思って、実験を開始しました。
大腸菌を使いました。実験室で使う大腸菌(K12株)大腸菌にも色々と系統があり、それぞれ違う特徴を持っています。ヨーグルトにビフィズス菌の株の名前が付いていたりしますよね?シロタ株とかBB536とか。同じような感じです。の外膜にはヘムを通す能力がないんです。だから、培地にヘムを入れても細胞の中に入らない。細胞の中に入らないということは、毒にならない。
それだと毒の研究ができないですよね?
そうですね。そこでちょっとひねって実験の工夫をしました。
大腸菌の外膜に、病原菌が持っているヘムを通すタンパク質を組換えで作らせるようにしたんです。そうすれば、この大腸菌の細胞の中にヘムが入っていきます。ヘムが毒だったら大腸菌は育たなくなりますよね。で、実際育たなくなるという結果になりました。
大腸菌にしたらいい迷惑ですね。
そうですね。なんてことしてくれるんだという感じ。
今度は、排出側ですね。
同じ菌に、先ほどお話しした遺伝子も入れてやると、また増えるようになるんです。
入れるタンパク質と出すタンパク質を両方持たせてやると、排出もできるからちゃんと生きて育って増えてくれると。
そうです。これで、ヘムを入れる・出すを人工的に作り出して、目で見てわかるようになったというわけ。
大腸菌からしたら、ほんといい迷惑ですね……。
そうですね(笑)イメージとしては、さっきの解毒するトランスポーターというのは、おそらく細胞膜の外にヘムをポンプのように汲み出している、と考えています。じゃあこのポンプの働きをしているトランスポーターというのはどんな形をしているんだろうかということです。
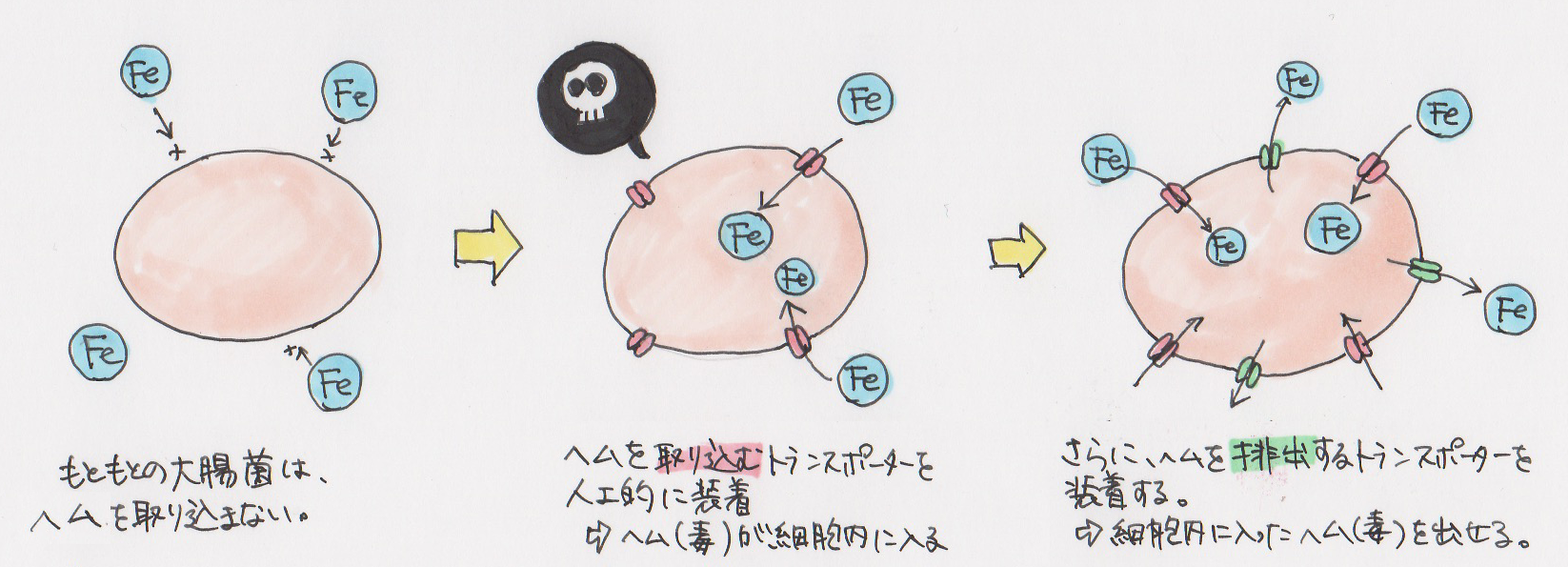
出し入れしている正体はポンプ
ABCトランスポーターって聞いたことありますか?
有名ですよね、名前は。抗がん剤を排出する話のときによくでてきますね。
ABCトランスポーターは、1970年くらいに見つかったタンパク質で、例えばヒトだと48種類あります。細菌も、例えば大腸菌だと80くらいあるのかな。そのくらいたくさん種類があって、細菌からヒトまで共通性があります。
それは、ATPを使ってエネルギーを変換する部分です。例えるなら、この部分はモーターと考えてください。このモーターの形や仕組みはほとんど同じです。
じゃあ何が違うのかというと、ギアやデバイスになる部分です。
例えばモーターでも、ギアが1個と2個とで回転の方向が変わりますよね。クランクを入れれば回転運動が並進運動になりますよね。そういうわけで、このABCというのはATP Binding Cassetteという英語の頭文字を取っているんですけど、このABCの部分は共通なんです。
モーターは同じだけどギアに相当する部分がそれぞれ違うので、その働き方や物質の運び方も変わってくるというわけです。
へー。
それで先ほどお話ししたように、このヘムを解毒する遺伝子が見つかったので、DNAの配列がわかる。つまり、アミノ酸の配列はわかる。その配列を解析すると、このモーターの部分がすごく似ているので、このタンパク質もABCトランスポーターだということがわかったんです。それは遺伝子発見の頃からわかっていたんです。でも、タンパク質は得られていない。
でも面白いですよね。一つの細胞の中にヘムを取り込むトランスポーターもあれば、外に汲み出すトランスポーターもある。そんな物質、おそらくヘムだけです。例えばアミノ酸を取り込むトランスポーターはあるけども、同じアミノ酸を外に汲み出すABCトランスポーターはないです。ヘムというのは生物にとって必要なんだけども、でも、毒でもあるということの傍証かもしれません。
一定程度の濃度範囲にいてくれないと困る。
そのとおりです。
構造をみてようやくわかること
それで、じゃあこのタンパク質の性質をいろいろ調べてみようということで、先ほどの大腸菌から細胞膜を取ってきて、界面活性剤で溶かして、カラムクロマトグラフィーなどを使ってきれいなタンパク質を取ってきました。まず、ヘムがこのタンパク質に結合する様子やATPを使う様子を生化学で調べました。
膜タンパク質は単離精製が難しいと聞きますけど。
難しいです。でも、僕ならできます。(ドヤ顔)
で、次に結晶化をしました。どうしても構造が見たかったのです。
膜タンパク質って結晶化できるんですね。
理研では、たくさんやっていますよ。
一つは、膜タンパク質は、大きい結晶をつくるのが難しいから、小さい結晶しかできない場合にも、SPring-8兵庫県の播磨科学公園都市にある世界最高性能の大型放射光施設。簡単に言えば、ものすごく高性能の顕微鏡で、分子の構造を解析するのに使われる。新材料などの解析にもよく使われている。(SPring8について)があるので構造決定ができるというそういう強みがあるんです。
結晶をつくったのは僕なんですけど、僕はX線を当てて、コンピュータで立体構造を決めるという能力、技能がないので、同僚の久野玉雄さんにお願いして構造を決定しました。結晶を僕がつくるから、構造解析はしてくださいと。
実は、構造解析の仕方も教えてくれ、と言って実際に習ってみたんですけど、これはちょっと僕には無理だと思って。
職人同士のコラボって感じですね。
ヘム類似体がついた状態、ATP類似体がついた状態、そしてなにもついていない状態、三つの構造を決めました。そうして、この決定された構造によって、初めてヘムがこのトランスポーターのどこについているかがわかりました。そして、はじめは少し開いていてヘムがくっつくことができるんだけど、足のほうにATPがくっつくと閉じちゃうということもわかった。
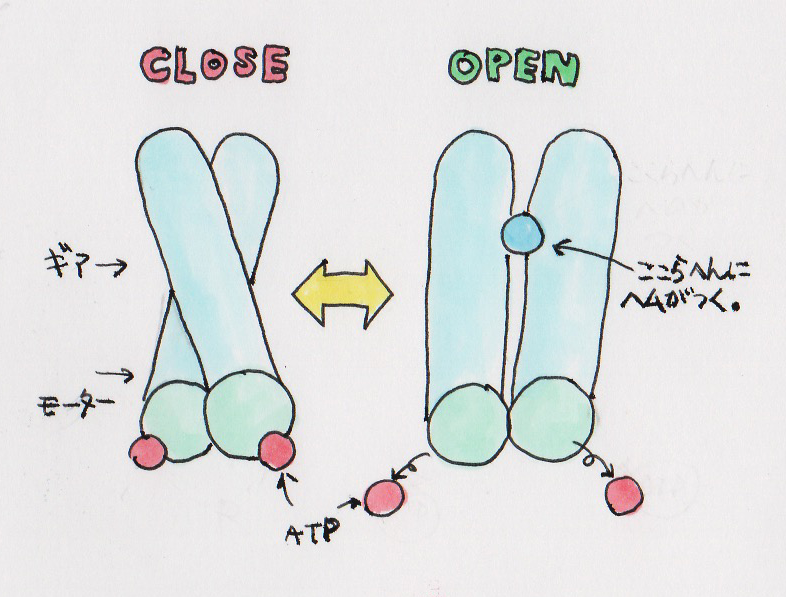
ATPがつくだけで、そんなに構造変わるんですね。
タンパク質というのはたったそれだけで、ほんのちょっとの構造が変わるだけでも、生化学的な性質はがらっと変わるんです。
これは遺伝子配列だけ見ていてもわからないですね。配列は100%同じですもんね。
今回、構造を決定できたのは播磨のSPring-8のおかげ、といえます。で、いま横浜にいるわけですけど、電子顕微鏡も最近熱心にやるようになりました。
新たな武器:クライオ電子顕微鏡
クライオですか。
そうです。クライオ電子顕微鏡です。
先ほどの構造は、X線結晶構造解析という方法を使いました。細胞膜から界面活性剤を使って溶かし、タンパク質を取り出して結晶化したものを解析の対象にします。つまり、界面活性剤に囲まれている状態のタンパク質溶液の結晶ということになります。だから、さっきお話しした構造というのは、タンパク質が界面活性剤の中にあるときの構造なんです。
ところが、界面活性剤に入っているときのタンパク質と、リン脂質膜に入っているときとで挙動が違うことがよくあるんです。ということは、自分が見ていた構造というのは、本当に膜の中で働いているのを反映した構造か、怪しくなってくる。
膜に入っている構造を見たい、と。
それを可能にしてくれるのがクライオ電顕なんです。

クライオ電顕は、最近ノーベル賞も出ましたけど、タンパク質単独じゃなくて、別のタンパク質と複合体になっているなど、今まで結晶をつくるのが難しかった状態のものの構造も解くことが可能なんです。
じゃぁ、膜タンパク質だったら膜の中にある状態が見える。ということですか。
そうです。そのために膜タンパク質の再構成という操作をします。さっき僕、界面活性剤に囲まれていると言ったんだけども、膜タンパク質と界面活性剤の溶液にリン脂質を入れます。そして、生化学的な操作で界面活性剤を取り除く。そうすると、脂質二重層の中にタンパク質が取り込まれたものを得ることができます。これが膜タンパク質の再構成です。
それは自動的にそうなるんですか?
膜タンパク質は水に溶けにくいので、自動的にそうなります。
集まっちゃうんですね。
電顕解析のために用いた再構成法はナノディスクという名前の手法なんですけど、簡単にいうと、直径10ナノメートルほどのリピッド(脂質)の円盤です。リン脂質の座布団みたいな感じですね。その中にタンパク質を埋め込みます。それを試料にしてクライオ電子顕微鏡で構造を見ました。
膜の中に埋め込まれているわけだから、リアルな膜環境での構造が見えてきました。
脂質膜中での解析を可能にしているということで、膜タンパク質とクライオというのは相性がいい。相性がいいというか、クライオだからこそできるという、そういう技術です。
それなら、もうやらない手はないですよね。
新しい抗生物質の可能性
理研ですから、この研究が何に役立つのかを示すことも大事だと思っています。
お話ししているヘムの排出ポンプ、実はいろいろな病原菌が持っているんです。
最近、抗生物質が効かない菌が増えているということを聞いたことがありませんか?
今ある抗生物質には、細胞壁の合成を阻害したり、タンパク質合成や核酸合成を阻害する薬というのがあります。だんだんそれらが効かなくなってきているということなんです。
耐性菌とか言われるやつですね。
じゃあ、このヘム排出ポンプの働きを止める薬がもしできたならば役に立つんじゃないかと考えているわけです。実際、このヘム排出ポンプを遺伝子操作でなくした連鎖球菌はマウスの血液中で死にやすく、増殖阻害されることが報告されました。
新しい抗生物質の探索ですね。
理研には化合物のライブラリーやスクリーニングの仕組みがあるので、それを片っ端から調べる実験も計画しているんです。精製したタンパク質を使って、それらの化合物が、活性を阻害するかどうかを見るという、感じです。
なるほど、見つかれば大発見ですね。
まあ候補になるものが見つかったときには、また別の方が間に入ってもらって、共同研究なり、あるいは産業に結び付けられることができればいいと思いますね。
そこは、理研鼎業さんがコーディネートしてくれると思いますよ。楽しみにしています。ありがとうございました。

編集後記
サイエンスカフェなどでもたくさん話をされている経験もあってか、話がお上手。
実際には最近はまっているという烏龍茶談義や、調理する鍋によって鉄分が全然変わってくるとか、同じ農作物でも産地によって変わるとか、トリビアな話もたくさんお聞きしたのですが、この記事を執筆する際にバッサリ削ったので、ご興味のある方は理研の一般公開やサイエンスカフェなど機会があったらぜひ足を運んでいただければ。
トランスポーターの話は、こちらもご参照のこと。
「病原菌が鉄を細胞内に取り込む仕組み -細胞膜で働くヘム輸送体タンパク質の立体構造を解明-」
