巨人の肩に乗る-クライオ電顕の躍進
超速い酵素やペプチドライブラリーの和田さんが紹介してくださったのは、クライオ電子顕微鏡の江原さん。サイエンスの話が面白かったので、記事はそちらにフォーカスして構成していますが、実はお話の中には理研で進めている産学官の共用の話もありました。興味がある方は特設サイトでご確認ください。(聞き手:薬師寺秀樹)
クライオ電子顕微鏡って?
早速ですが、どんなお仕事されているんですか?
細胞内の転写に関わる複合体の構造解析というのを、メインテーマとして仕事をしています。転写というのは、DNAに書かれた情報を読み取って、メッセンジャーRNAを合成するステップのこと。遺伝子が働くための最初の一歩で、すごく大切なんですよ。最近は主にクライオ電子顕微鏡(以下、「クライオ電顕」)を使って、真核生物の転写に関わる巨大複合体を、分子が見える倍率で観察しています。あ、巨大複合体、といっても、細胞の中にあるものだから、実際にはとても小さい世界の話です(笑)それで、私たちの細胞の中には、タンパク質やDNAで出来た複合体、だいたい数十ナノメートルぐらいの大きさなのですが、そういうものがたくさんあって、そういったもの同士がくっついたり離れたりしながら転写が進んでいくんです。でも、細胞の中のすごい小さい世界で起こる現象だから、実際に何が起きているのかは、世界で誰も見たことが無い。だから、クライオ電顕を使って実際に観察して、その謎を解き明かしていきたい、と思っています。
クライオ電顕ってどのくらい細かいところまで見られるんですか?
最近はすごくデータが良くなっていて、2.5Å(オングストローム。1Å=10nm。)程度の分解能は珍しくなくなってきています。アミノ酸一つ一つが見分けられるサイズ感です。
アミノ酸が見える……?(まじか!)
アミノ酸は20種類あってそれぞれ形が違うんですけど、データがよければそのくらい行きます。
そもそもですけど、クライオ電顕ってどんな仕組みでしたっけ……?
基本的には電子顕微鏡なので、可視光じゃなくて電子線を使うんですが、タンパク質とかはそのままでは扱うことができないので、ちょっと処理をします。タンパク質の溶液を用意して、うすーく凍らせます。シャボン玉の膜みたいな薄さで、氷の膜を作って、そこにタンパク質がポチポチあるというような状態になります。ここに電子線を当てるとその中にいる粒子が見えるという寸法です。
それだけで、Åの解像度が出るんですか?
実はこれだけじゃなくて(笑)。もちろん1個のタンパク質を見るだけでは、精密な画像にはならない、というか実際にはとても汚くてなんだか分からないんですが、溶液の中には同じタンパク質がたくさんあるわけじゃないですか。そこで、それらのデータを全部集めてきて、足して、平均するとクリアな画像が得られる、という仕組みなんです。
ん?でも、そのタンパク質ってそれぞれあっちこっち向いていません?
その通りです。なので、いろんな角度からのデータが撮れるので、最終的に立体画像にすることができるんです。
最近流行りの3Dスキャン(たしか、フォトジオメトリーとか言ったような)な感じですかね。
実はコンピューターも大切なんです
もともとのデータ一つ一つは、そんなに解像度が高くなくて、それが何十万とあると高解像度にできる、というのがクライオ電子顕微鏡(単粒子解析)の技術のキモでもあります。
ちょっと待ってくださいよ。そうすると、計算パワーがめちゃくちゃいりませんか?
いりますよ。実は、今ここがボトルネックになっています。新しいクライオ電顕があって調子良く動いてくれているんですけど、その後のデータ処理が追いついていないです。
マシンが足りない?パワーが足りない?
そもそもマシン台数が足りないですね。GPUという最近だとAI等にも使われるプロセッサーがあって、これが4枚挿さっているマシンが15台くらいあるんですが、常時稼働している状態です。
もう、クラウドに移行した方が効率いいかもしれないですね。
電顕や解析から生み出される、データ量がとても多いので(一日に数TB)、それはそれで簡単にはいかないところです。どこも苦労してるんじゃないかな(笑)
ぐるぐる巻きのDNAの上を
ところで、細胞内の転写に関わる複合体の構造解析をやってらっしゃるということでしたが、どんな構造を観察しているんですか?
そうですね、例えばこんな感じの形をしています。
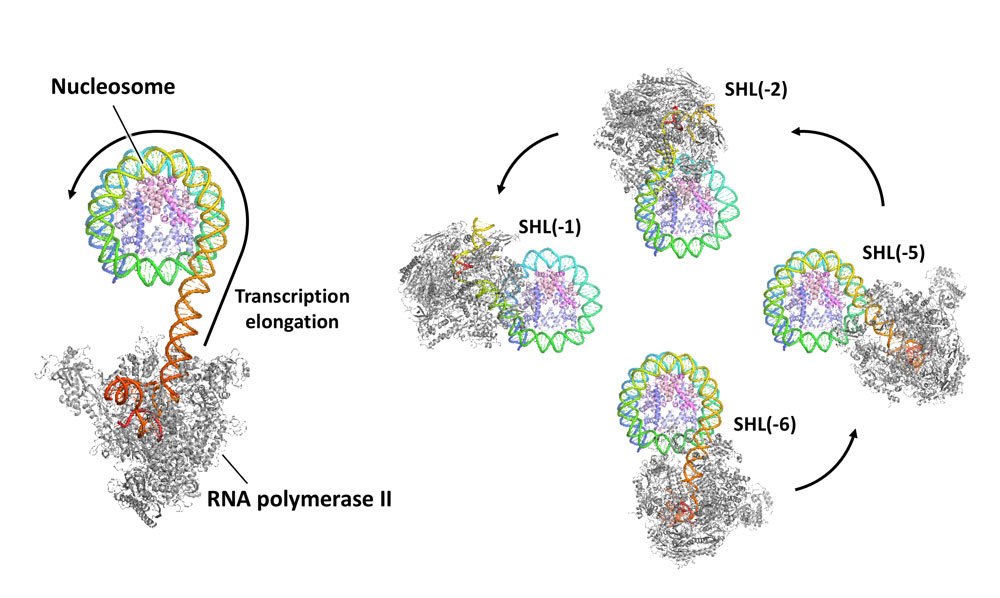
これいくつか微妙に違う形があるんですが……?
さっき、溶液の中にはたくさんタンパク質粒子がある、ということを言ったんですが、実際には少しずつ形の違うものが混ざっています。データ処理の過程で、それらを選り分けて、何種類もの構造を同時に見ることができる、というのもクライオ電顕の利点ですね。
なんか巻いている感じが見えますね。
カラフルな円盤の方がヌクレオソーム、グレーで描いてある方がRNAポリメラーゼと言います。あ、分かりやすく図に色付けしてあるだけで、実際の分子に色があるわけでは無いです(笑)
ちなみに構造がいろいろあるのは、もしかしてタイミングの違い?
細胞の中にあるDNAって、ただのフラフラした紐じゃなくて、クロマチン構造という折り畳まれた形を取っています。その基本単位の中にヌクレオソームという円盤があるんですけど、この円盤の周りにDNAが巻き付いて、そのおかげで、すごい長いDNAが細胞の核の中にコンパクトに畳み込まれています。
このDNAの情報を読み取るのがRNAポリメラーゼという酵素なんですけど、でも、こんなにきっちり巻かれていると困りますよね?どうやって読み取るんだろう?ということで、実際にRNAポリメラーゼをDNAが巻いた状態のクロマチンに反応させて、どう変化するかというのを見たのがこの研究なんです。
ということは、RNAポリメラーゼがDNAの上を走っているスナップショットがいっぱい、ってことですか!
そうです。よく見ると少しずつ剥がしていって、さらに剥がしていって、ぐるっと回っていく、というのを世界で初めて見ることができたんです。
これまでの蓄積があるからこそ
すごいなぁ。ここまで来ると「本当にこうなってるの?」みたいな話になりそうですが……。
実は非常に重要な点として、クライオ電顕のデータだけで物事を語っているわけではない、ということがあります。結晶構造解析の歴史は長く、部分部分であったりはしますが原子レベルでの構造解析データの蓄積があります。そういった過去のデータを参照しながら、分子モデルを構築していきます。
長い積み重ねがあるんですね。いきなりコンピュータで解いてこうなりました、ボーンというわけじゃないということですね。
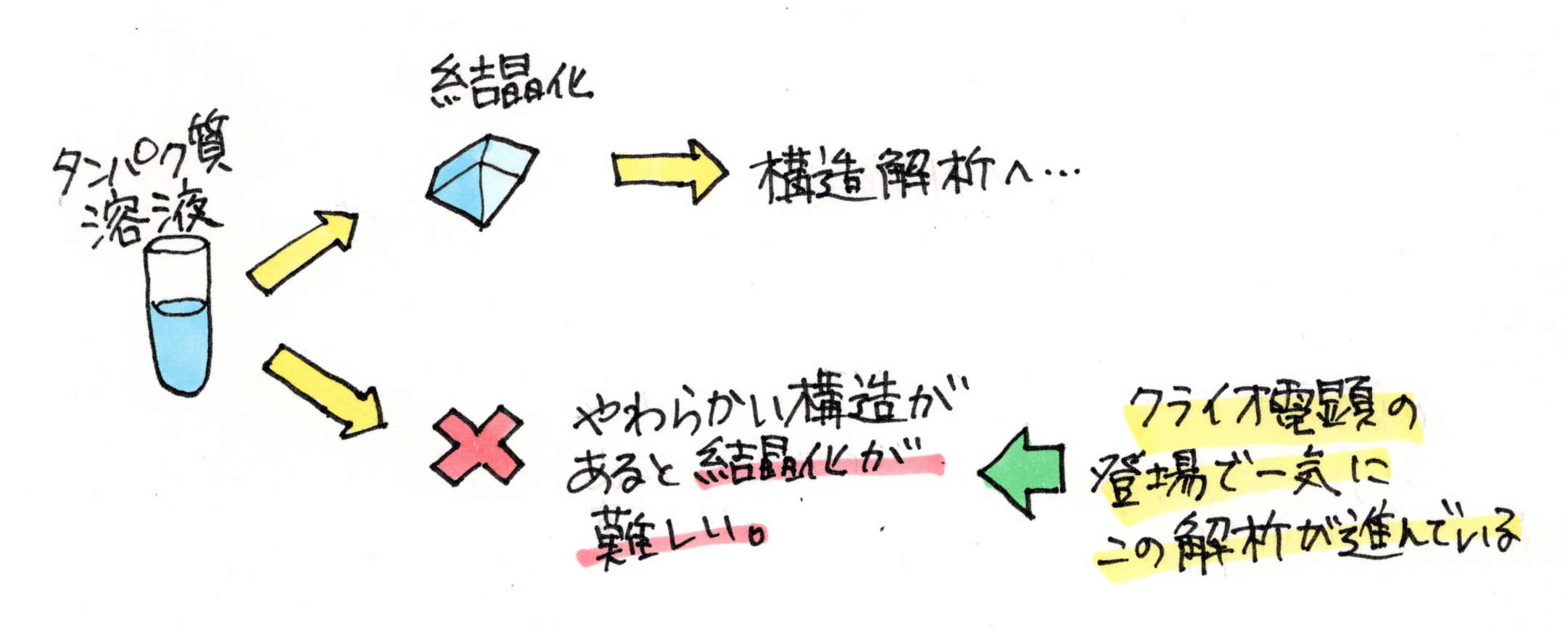
クライオ電顕の登場までは、高い分解能での構造解析には結晶を作らせることが必要でした。これは、精密に分子構造を解析するためには非常にパワフルなんですが、問題は「結晶」でした。一つはそもそも結晶を作らせるのが非常に難しいこと。結晶が作れない場合も少なくありません。
たしかに、和田さんのお話にもそんなところがありましたね。
特に厳しかったのは、結晶を作らせるためには、均一なものでないといけない、ということ。さっきのRNAポリメラーゼの話もそうですが、生体分子はカチッとしていなくて、ぷらぷらしている部分とか動く部分があるし、分子同士の反応を見ようと思うと、一つの構造には決まらないことの方が多い。
あ、そうすると結晶にできない。
そうなんです。なので、動きのあるものは見ることは難しかった。ですが、これまでの精密なデータの積み上げと、動きのあるものも見ることができるクライオ電顕の登場により、ダイナミックな生体分子のリアルが見えるようになってきたんです。実際、クライオ電顕以前は結晶で構造解析を頑張っていたんですが、結晶が作れず苦しんでいた時がありました。そこにクライオ電顕が登場し、それまで作っていたサンプルをクライオ電顕で観察したら、どんどん先に進んでいった、という感じなんです。
リアルな分子で語る生物
分子生物学の教科書に登場するタンパク質って、マンガというか、ただの丸とか四角形とかで、なんとなくこういう感じというイラストで描かれてることが多いんですが、全部がちゃんと構造の図になっていくといいな、と思っています。
たしかに、論理上の説明の時はカタチは大きな問題ではないけど、ちゃんと構造の図になっているとよりリアル感でますよね。
その先は細胞の中をやりたいですね。今、見えているものは、あくまで取り出したタンパク質なわけで、細胞の中でも同じような状態になっているかは誰にもわからない。もちろん、近い状態のはずだという環境を作ってやるわけですけどね。
確かにそうですね。
細胞を直接削って、細胞の中を直接顕微鏡で見て、しかもこれくらいの高解像度までいけば、夢じゃないと思うんです。
見たい、見たい。
たぶんこの先5年、10年くらいの課題なんじゃないかなと思っています。今の時点でクライオ電顕でやっているような仕事が、次の研究のベースになっていくと思います。細胞の中を見たとき、最初はそんなに解像度高くないけど、今までのデータとも統合するとこうなるはずだ、ということが積み上がっていく。最初はそのへんから始まっていくとは思います。

編集後記
先人の蓄積があるからこそ、今の仕事がある。今の仕事も次の世代の土台になっていく。という話は、なんだか最近の裏テーマになりつつあるなぁ。いわゆる「巨人の肩に乗る」という話だけど、どの分野も同じだってことだな。クライオ電顕が登場して、一気に世界が変わった気がするのだけど、これも「イノベーションは一晩で起きない」という話と同じだなぁ。
