生命分子を人工的にデザイン
前回いきなりの液-液相分離からバイオ電池まで話が広がった美川さんからご紹介いただいたのが、今回の和田さん。もしかしてまた壮大な話だろうか……と思っていたら、案の定スケールの大きい話を聞くことになりました。(聞き手:薬師寺秀樹)
超速!金属酵素の反応!
どういうお仕事をされているんですか?
所属するチームは非天然型アミノ酸技術研究チームというんですが、私自身はアミノ酸を純粋に研究しているわけではないんですよ(笑)。密接な関連はあるんですけど・・・。
実は、私は化学分野の出身で、主に「錯体化学」をやっていたんです。いわゆる金属錯体というものです。ただ、生命と全く関係がないわけではなく、金属酵素を試験管内でモデル化するような化学をやってました。特に金属酵素の活性中心である金属イオンに着目して。
金属酵素って、タンパク質の大きな構造の中に金属である鉄とか銅とか亜鉛とかマンガンなどを取り込んで、その金属のそばにあるアミノ酸たちとコラボレーションしながら特殊な反応を触媒してるんです。特に金属酵素の反応はとっても速いんです。そのため、実際の反応を担っている中間体、ここでは“反応活性種”というんですけど、それを捉えることってほぼ不可能なんです。超速すぎて見えない。
どのくらい速いんですか?ちなみに。
例えば、1秒間に数千から数万回転。ここでいう回転は、1反応の最初から最後までと捉えると、酵素1分子が1秒間に変換する分子の数が回転数です。つまり、金属酵素の反応は、1秒間に数千から数万回おこなわれるため、実際どんな分子を経由して反応が進行したのか明確には分からないんです。
msec(ミリ秒)ということですね。
そうですね。タンパク質や酵素の研究では、反応の最初と最後の物質が何であったかという点から、どのような反応が起こったかを推測したりするんです。とはいえ、私としては実際に見てみたいと思いまして・・。
確かに、見えていないと、見えないものを見てきたように語ることになりますからね。
そうそう。それで、試験管内で金属酵素をモデリングして、実際に反応中間体を合成し、その分光学的・構造学的な性質を見極めると、実は、こんな分子が反応活性種として存在していて、金属酵素の反応を担っているんだということを立証できるんじゃないか!と。
モデリングで、その瞬間をフリーズ
ちょっといくつか分からなかったんですけど、モデリングというのはどういう作業なんですか?
例えば、鉄の活性中心を持つ金属酵素があるとするじゃないですか。ということは、タンパク質の内部には、鉄に結合して留めておくアミノ酸があるわけです。ちなみに、この金属とアミノ酸の結合は、非共有結合性の配位結合が使われているんです。
ポルフィリンみたいなのが囲っているようなイメージ?
そうそう。ただ、私の場合、ポルフィリン(ヘム)を持たない金属酵素に注目していました。いわゆる非ヘム金属酵素というものなのですが、こちらの方が構造と機能が多様で面白みを感じていましたので。
そうするとアミノ酸残基のどれかがポルフィリンの構造みたいな配位をして囲っておくことになるんですかね?
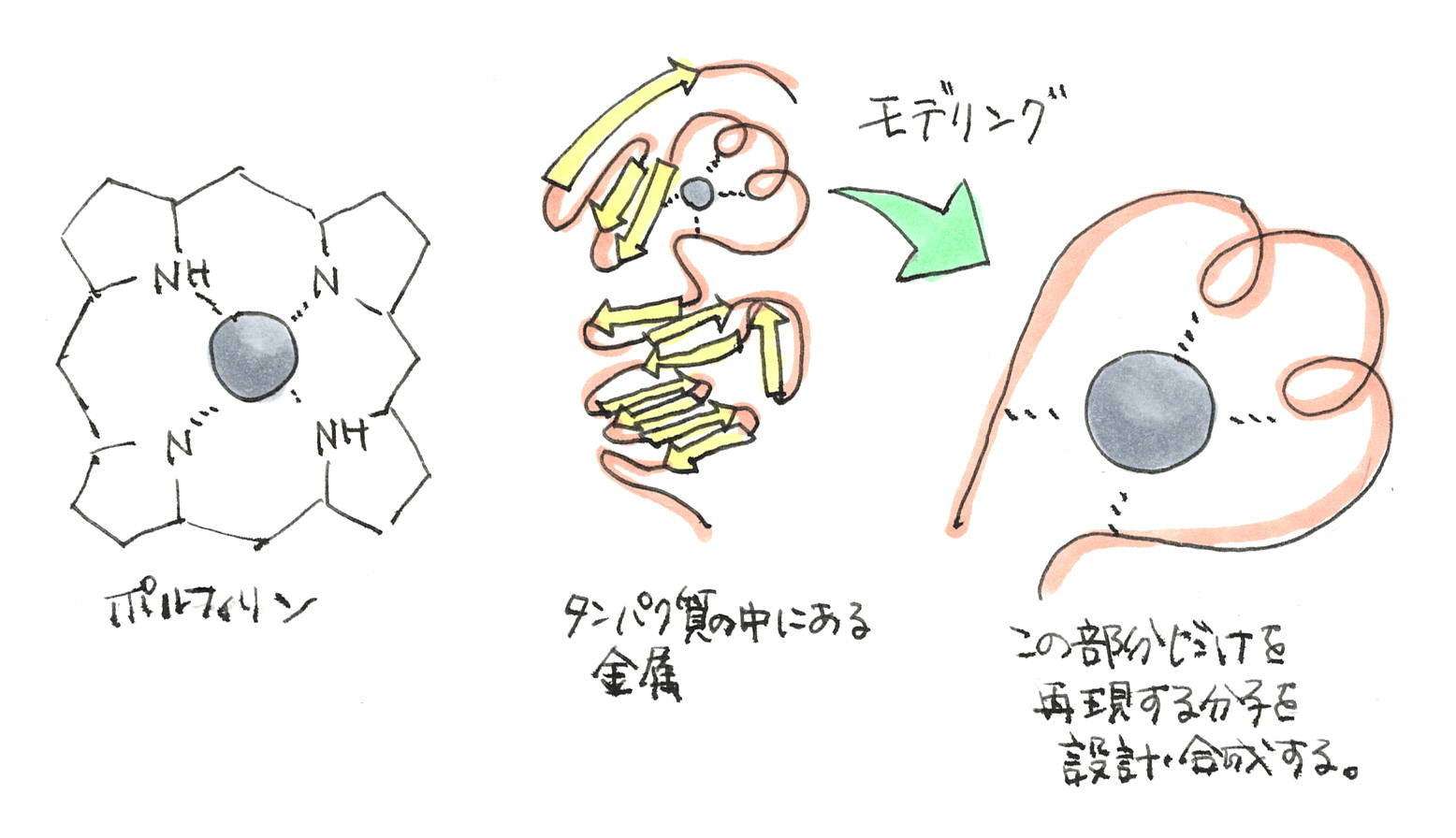
そうなります。例えば、金属に結合するアミノ酸が4つか5つくらいそばに存在していて、金属の活性を制御しているんです。具体的には、酸素原子を介して金属に結合するアスパラギン酸やグルタミン酸。あるいは、窒素原子を介して金属に結合するヒスチジンが代表的ですね。
また、金属の種類ってさまざまなんですけど、金属酵素は、ちゃんと自分の好きな金属を選んで、ちゃんと自分の中に納めて、正確で超速い反応を行います。この時、金属に結合するアミノ酸の位置と距離がすごく重要なんです。さらに、気体としての酸素や窒素を取り込んで触媒反応を行う金属酵素もありますから、分子レベルの動作は極めて精巧にできているんです。
ここにこういうふうな残基があるだろう、みたいなのを作っちゃうということですか?
そういうことです。長くなりましたが、金属酵素の内部において「金属イオンとアミノ酸が構築している反応場」を金属錯体で再現する。これをモデリングと言っています。
でかいタンパク質の構造じゃなくて、金属の周りの部分の環境だけを再構築するわけだ。比較的小さい分子で。
そうなんです。例えば、鉄酵素であれば、鉄イオンの周りに酸素原子あるいは窒素原子が適切な位置で結合する有機分子を作ってから、鉄-有機分子の複合体(鉄錯体)を合成します。ただし、この状態は、タンパク質の構造に覆われていないむき出しのようなものなので、温度や有機溶媒などによる物理化学的な条件をうまく調整し、擬似的にタンパク質内の環境を作って安定させます。
そんなことできるんですか?
はい、できます。
当然ですが、水の中にあるタンパク質は、-20℃の環境ではすぐに凍っちゃって働くことができなくなりますよね。だけど、試験管内で合成した金属錯体は、-80℃あるいはそれよりも低い温度でも観察できます。そうすると、室温では1秒未満で終了してしまう反応の速度をグーッと遅くしてあげることができるんです。つまり、反応中間体という未知の分子を捉える条件が見えてくるわけです。
見えるかどうかはやってみな
もう一つの質問はまさにそこだったんです。さっきおっしゃったように、1秒に何万回も起こるような反応なので、それを再構成したとしても、結局速すぎて中間体が見えないんじゃないか?と思ったんです。
おっしゃる通りで、室温で反応を行うと、頭(最初)としっぽ(最後)しか見えないんです。つまり、その間の胴体は見えないので、温度や溶媒などで周りの環境を調整してあげることで見やすくしてあげるわけです。とはいえ、実際はそんなに簡単ではないのですが(笑)。
当時の研究に関していえば、周囲の研究者からは、「絶対無理だからやめな」と言われていたんですけど、分光学的な性質を解析してみると、私は反応中間体を捉えていると確信があったんです。
見えているんじゃないか、と。
そうです。とはいえ、研究の途中段階で周りに話をしても説得力がないと思いましたので、一番分かりやすく見える形にするしかないと思い、反応中間体の結晶化とそのX線結晶構造解析にチャレンジすることにしました。
今まで見えなかったはずの状態を低温に持っていって、なおかつそれが結晶化するわけですか?かなりハードル高そうですね。
そうなんです。当時、-80℃のディープフリーザーを何台か整備し、すべて結晶化のために使用することなんて不可能でした。ただ、幸いだったのが、室温に近い条件でも反応中間体ができてるんじゃないかという感触があったので、一般的な冷蔵庫でも結晶化するかもと思ったんです。そこで、冷蔵庫2台くらいを確保し、端から端まで結晶を出すための試験管を詰め込み満杯にしたんです。だけど、結局そこからは出てこなくて・・
出てこんかったんかーい!(笑)
室温に出しておいた余ったバイアル瓶から結晶が取れたんです(笑)。
そっちかーい!(笑)
「結晶が取れた!」と意気込み、ワクワクの高揚感のまま構造解析をしたのを今でも覚えています。結果としては、ハイドロパーオキソ種という「OOH」の組成をもつ小分子が銅イオンに結合した銅錯体であることが明らかになりました。これは、長年、金属酵素の反応活性種として重要視されながらも、その存在を確認できなかった未知の分子だったんです。
それ反応式でよく点々で書いているやつじゃないですか?
点々です。生化学の反応において、こんな中間体を経由しますよというカッコ付きで書かれているもので、「見たことないだろう」というレベルです。
それが見えたということですか?
そうです。
ちょっと難しいんですけど、通常、ハイドロパーオキソ種の酸素-酸素結合は、ブチッと切れてより活性の高いオキソ種という分子に変わってしまうんです。ただ、今回は、次の反応に行かせない、スナップショットの様にピタッと止まったフリーズ状態の金属錯体ということになります。つまり、生体内の金属に結合したハイドロパーオキソ種という分子が自然界に存在するんだということを知らしめた研究成果でした。
多分、このような経験の積み重ねが、研究者の世界で生きていこうと思った動機になっていると思います。今まで見たことのない分子や現象を科学的なデータに基づいて証明する。そして、挑戦的な研究が持つ意義とインパクトが自分の中で響いたんだと思います。だから、ある意味今も続けられてるんじゃないかな。
サイエンティストとしての原体験みたいな感じですね。
はい。ただ、この時期には、錯体化学に関して、ある意味、達成感を感じていたのも事実です。
じゃあ今は違う方向なんですね(やっぱり)。
そしてペプチドバイオテクノロジーへ
大きく分野を変えたいと思い、タンパク質工学やバイオテクノロジーの分野に入っていきました。これまで、金属酵素のモデル化でうまくいっているような話をしましたが、やはり天然の酵素やタンパク質って洗練された構造と巧みな機能を獲得していて、簡単に一から作れるようなものではないんです。であれば、その酵素やタンパク質を一から学び、人工的にデザインできるところまで行けないかと思うようになっていました。
今はどういうのが主体になっているんですか?
主にペプチドバイオテクノロジーに取り組んでいます。
自然界のあらゆる生命体って、酵素、タンパク質、脂質、核酸などで構成されているんですけど、その中の特定の分子に対して人工的に設計したペプチドが働きかけることができたら、生命現象をピンポイントに制御できるのではないか?と。
それで創薬という話につながってくるわけですね。
そうなんです。一般に医薬品として知られる化合物は、疾患原因の酵素やタンパク質にアプローチして、それらの機能を阻害もしくは誘導したりするんです。ただ、そのような化合物の開発であれば、有機合成を専門とする研究者の得意とするところです。私の場合、どちらかといえば無機合成を専門とする研究者でしたので、かなり後発になるわけです。そこで、試験管内で圧倒的な多様性を生み出せるような人工分子を見つけて、それを創薬に活かせる技術を開発してはどうかと思ったんです。そこでペプチドに目を付けました。
SELEXやアプタマーみたいな記載もどこかで拝見したことがあるんですが・・。
よくご存じですね。SELEXは、さまざまな配列をもつ核酸のプールの中から、標的に対してアフィニティ(親和性)の高い核酸のみを抽出・増幅していく技術です。核酸は、遺伝情報だけじゃなくて、その立体構造も配列によって多種多様なんです。ただし、核酸の骨格はリン酸基のため負電荷を帯びてますから、細胞の中に入りにくかったり、生体内の酵素により簡単に分解してしまう性質があるので、核酸創薬の開発には特殊な細工が必要になります。
一方、自然界のペプチドは、20種類のアミノ酸で構成されています。例えば、9個のアミノ酸が連結した小さなペプチドであったとしても、20種類のアミノ酸をランダムに使用して合成すれば、20の9乗、つまり、約1011種類を超える多様性を生み出せるわけです。そこで、その膨大なペプチドの集団(ライブラリー)の中から、病原体を検出するようなペプチドを探し出せば、バイオセンサーとして利用できるんじゃないか?がん細胞のアポトーシスを誘導するようなペプチドを見つけられるんじゃないか?と思い、任意の標的に結合する人工ペプチドを生み出すための技術開発を始めたんです。
超速!ペプチドライブラリーの構築!
なんらかの働きを持ったペプチドを探そうとなると、ある意味総当たり戦のスクリーニングみたいになっちゃいます?
そうですね。そこで、私は、無細胞翻訳システムとリボソームディスプレイ法を融合した技術に特化して作り込んできました。先ほど、1011種類のペプチドで構成したライブラリーを生み出せるという話をしましたが、そのペプチドライブラリーは、1.5 mlのチューブの中で約15分で合成できるんです。
15分で?マジスカ?超速いんですけど。
有機合成的手法によりペプチドを作る場合、一般的には固相法という方法で1個ずつアミノ酸をつなげていきますので時間がかかります。一方、私の場合、無細胞翻訳システムを活用しています。いわゆる生細胞で行われている翻訳反応を試験管内で行えるというものです。まさに生命機能の素晴らしさなのですが、ほぼ正確に1011種類のペプチドを超速で作ってくれます。
ぱっとお聞きして疑問が2つばかり湧きました。1つ目は、標的に結合するペプチドが1分子だけあってもスクリーニングするのは難しかろうな、というのと、2つ目はペプチドってDNAとかRNAとかと違って増幅やクローニングができないから、量的に少ないと検出できないだろうなというものです。1011種類ものペプチドが入っているとどんな手法でも分離できないじゃないですか。スペクトルでも分離できないと思うんですよ。
簡潔に言うと、標的に結合したペプチドだけを選択する操作を繰り返すことで解決しています。
例えば、ペプチドライブラリーの中に、標的の立体構造にフィットして、強力に結合するペプチドが存在していた場合、そのペプチドだけを選択し、それ以外は排除するという条件付きの操作を繰り返します。つまり、標的結合性を発揮するペプチドだけが生き残る、いわゆる自然淘汰という現象を試験管内で再現するんです。

また、通常、リボソームによるmRNAの翻訳が進行することでペプチドが合成されるのですが、その合成が終了すると、ペプチド、リボソーム、mRNAは、それぞれに分離して拡散しちゃいます。そこで、リボソームディスプレイ法では、ペプチド、リボソーム、mRNAが互いにくっついた複合体の状態を維持させる工夫をしているんです。これにより、標的に結合したペプチドを提示する複合体のみを選択すれば、そのペプチドの配列情報を有するmRNAが回収できます。そして、そのmRNAを逆転写した後、PCRで増やしてあげれば、数分子のペプチドであっても検出可能なレベルに達します。
なるほど、RNAならPCRに持っていけますね。
ただし、その操作を1回だけ行っても目的とするペプチドを得ることはできません。この操作を6~7回くらい繰り返すことで、標的にくっつくペプチドをどんどん増やし、くっつかないペプチドはどんどん減らしていくんです。そうすると最終的には、標的に結合する真のペプチドだけを濃縮・同定することができるわけです。
広がる応用への期待
なかなか応用が広そうですね。
そうですね。ペプチドの膨大な多様性を活かすという意味では、バイオ医薬の開発においても威力を発揮すると考えています。
今ペプチドって、創薬の分野ではすごく注目されていて、東大の菅先生のペプチドリームなんかが有名ですね。
東大の菅先生は、ペプチド創薬において先駆的な研究をなされていますね。ただ、仮に私がバイオ医薬を開発するのであれば、先達と同じようなものを作るつもりはないんです。現在、ペプチドにしては大きいけど抗体にしては小さい・・そのくらいのサイズ感の新しい生命分子を開拓しています。
なんだかしゃべれないことが多そうですね……。
ぜひ何年か後にもう一度、リターンズみたいな感じでお聞きください(笑)。
いいですね。それ。「ええ? そうだったんですか?」みたいな話を何年か後にしたいですね。
とは言いながら、話ができるまでに4~5年はかかるかもしれませんし、はたまた、間違った方向に進んでいれば徒労に終わってしまうこともあるでしょうね。そういうリスクを背負いながら、どこまで個人研究を追求できるのかは不透明な部分もありますが、個人的には引き続き挑戦していこうと思います。
そういうチャレンジングな部分がないと前進はないでしょうからね。ぜひ頑張って欲しいです!
オッと最後にもう一つ、金属錯体からペプチドに移ってきたんですけど、実は金属錯体の方を復活させているんです。
おお。つながるんですね。
ペプチドバイオテクノロジーに取り組んでいるときは、今後、金属錯体を扱うことはないんだろうと思っていたのですが、最近、研究者として思うところもあり、もう一度、金属錯体に関連したオリジナル研究を生み出してみようという思いが湧いてきたんです。〇〇〇の分野においてでですが・・。
なんと。それしゃべって大丈夫ですか?
あ、ダメですね。このくらいにしておきます。
なんだか、いろいろと技術的にも事業的にも面白そうですねぇ。今度ゆっくりお話を伺いにお邪魔します!
ぜひぜひ。お待ちしてます。「続報を待て」ということで!

編集後記
こう言ってはよくないかもしれないが、画面越しの印象が落ち着いた感じだったので、淡々と研究の話をすることになるのかしらと思ったのだけど、なんのなんの。情熱を持って研究をしていて、話も盛りだくさん。むしろ話を止めるのが申し訳ないくらいにいろいろ話していただきました。技術的にも事業的にも面白く、書けない情報もかなりあり、技術移転関係の人は要チェックな研究者ですぞ。
