先端科学を支える先端技術
神経幹細胞の分化タイミングを通して生き物の時間を理解しようとしている呉さんから紹介されたのは、研究の基盤を技術で支える阿部さんでした。(聞き手:薬師寺秀樹)
神戸理研の屋台骨
かなり昔からあるラボの所属だと聞いてきたんですが。
そうです。通称LARGEです。Laboratory for Animal Resources and Genetic Engineeringの略で、LARGE。
なるほど。
マウスの飼育管理と、理研を含めた主に国内の研究者と共同開発で遺伝子改変マウスを作るということもやっています。
ラボとして大きく二つの役割があるんですね。
そうです。
歴史は非常に長くて、CDB発足の2000年から続いている研究支援ラボです。
ということは、神戸の理研の土台みたいな部分がありますよね。いろいろ研究するにあたって、研究資材はやっぱり必要で、それをがっしりサポートしている、という感じで。
マウスを使う研究者に対してですが、そうでありたいと思っています。特に僕は、研究者が必要とする遺伝子改変マウスの作製をサポートしています。
実は職人技だったES細胞
「CRISPR/Cas9」って知っていますか?
知っています。最近よく聞きますね。ゲノム編集の話ですね。
CRISPR/Cas9システムを利用したゲノム編集技術が登場する前は、遺伝子改変マウスは「ジーンターゲティング」という手法で、ES細胞を使って作るというのが主流でした。だけど、この作製法はいろいろな工程があって、技術的にも難しく、遺伝子改変マウスを使って研究しようと思う研究室が、よし作ろうと思って簡単に作れるものではありませんでした。そのため、遺伝子改変マウスを作れる研究室は限られていました。その技術の一つとして、良質のES(胚性幹細胞)細胞を維持する培養技術があります。遺伝子改変したES細胞からキメラマウス経て、目的の遺伝子改変マウスを作るのですが、キメラマウスになるES細胞をきちんと良質な状態、未分化な状態を維持して培養できる研究室は限られていたと思います。
なんで難しいんですか?
ES細胞を未分化な状態に保ちつつ、細胞の数を増やしていくのが、当時は難しかったそうです。今は培地の改良が進んで昔ほど難しくなくなったようですが。培地に含まれる血清の製造ロットが変わったり、細胞を扱う操作のちょっとした違いとかで、未分化な状態を維持できなくて分化してしまうような不安定さとかがあったようです。
質がよくないES細胞だとマウス胚に入れても、生まれてくるマウスにそのES細胞が寄与してこなくなります。
寄与してこなくなるというのはどういうことなんですか?
ホストの胚にES細胞を入れて、そのホストの細胞とES細胞からできてきた身体を構成するいろいろな細胞が混ざり合って個体になるのですが、一番いいのはES細胞由来の細胞から個体が発生した、100%ES細胞からできている個体です。ES細胞が持っていたゲノムDNAだけを持っているマウスが生まれてくるわけです。このことを寄与と呼んでいます。
だから寄与率が悪いES細胞を使うと、ホストの細胞由来の細胞をたくさん持った個体が生まれてくるわけです。身体のすべての細胞がホスト由来だと、これは単なるホストの個体なので、つまり遺伝子改変マウスが作れていないということになってしまいます。寄与率が50%の状態だと、身体の半分がホストの細胞由来で、残り半分がES細胞由来のキメラマウスになります。だからES細胞の未分化能が保てていないと、寄与率が9対1とか、100対0とかになってしまって、遺伝子改変マウスが樹立できないことになります。
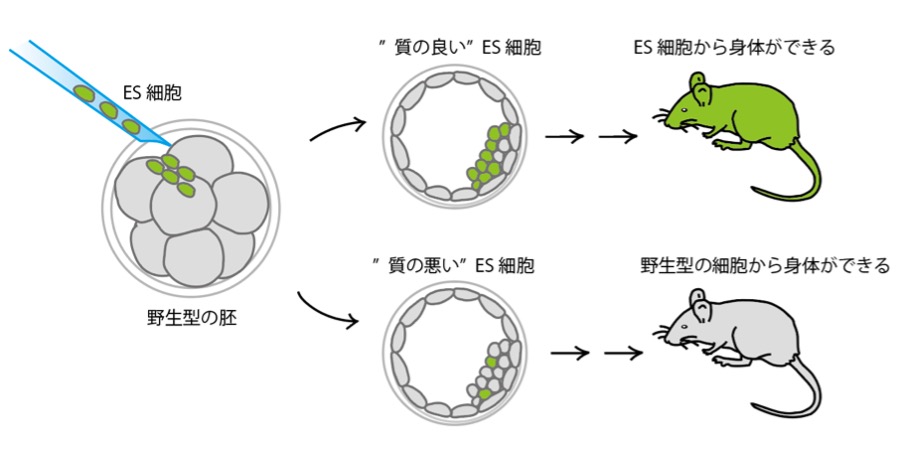
なるほど。ES細胞の品質が重要なんですね。
作製期間もキメラマウスが生まれるまで8ヶ月程度必要でした。
一般の方からすると、ライフサイエンスの結果がなかなか出てこない、と思うかもしれないですけど、そもそも準備の時間がかかるところにも由来するんですよね。
世界中の研究者に提供
LARGEではこのES細胞を使った遺伝子改変マウス作製を用いて、蛍光タンパク質であるGFPなどを使って光るマウスを作りました。GFPで細胞の核、ゴルジ体、ミトコンドリアとか、細胞小器官を蛍光タンパク質で光らせて、ライブイメージングできるようなマウスです。
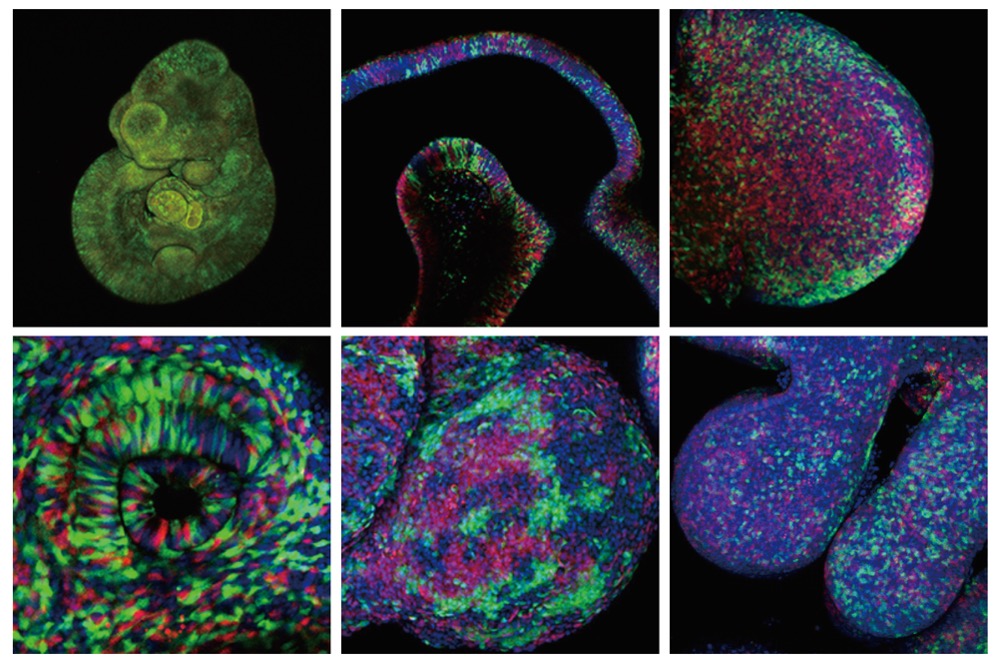
おお、すげー。
全部で16種類くらいあります。これまでに国内外の多くの研究室に提供してきました。
それはすごい。こういう地道な技術開発も必要なんですね。
CRISPR/Cas9は比較的簡単
そうした中でCRISPR/Cas9によるゲノム編集技術が登場してきました。CRISPR/Cas9は狙う20塩基の配列とNGGという配列があれば、Cas9タンパク質がそのゲノム領域を特異的に認識して切ってくれます。それを利用して、遺伝子を壊したり、狙った位置に入れたい遺伝子を入れたりすることができるようになりました。この操作は受精卵に直接行います。そうすると、ES細胞を使ってキメラマウスを作る必要もないので技術的なハードルが下がって、工程もだいぶ簡素化できます。結果として、2ヶ月で目的の遺伝子改変マウスが作れるようになってきました。
めちゃ早いじゃないですか。受精卵は1細胞だから、ちゃんとゲノム編集ができてれば、確実に遺伝子改変された個体になりますね。
しかも、それ以前は遺伝子改変ができなかった動物でも可能になってきています。
さっきの20塩基は、ゲノムの中の特異的な配列で「そこを切れ」の場所を指定するためのものですよね。他に似たような配列があったら、そこも切っちゃうんですか?
当初、懸念されていたオフターゲットエフェクトですね。目的のところにしかない配列を使っても、似た配列があることもありますが、本当に特異性が高いと言われているので。
でも、CRISPR/Cas9は切るだけですよね?
そうです。切れたDNAは自然に修復されるときに似たような配列が存在するとある程度の確率で取り込まれます。なので、入れたい配列を一緒に入れておきます。何も入れないと切れた箇所から削れたりしてノックアウトになります。
よく考えたら、すごい遭遇確率ですね。どうやって見つけるんでしょうね。
目で見てみたいですよね。
より安定した技術を目指して
さっき、CRISPR/Cas9を用いた遺伝子改変マウスの作製は簡単とは言ったものの、実はGFPと言った外来遺伝子をゲノムに挿入するノックインの効率はとても低い、というハードルがありました。
ですよねぇ。ひとまずDNAとその入れたいものが出会わないといけないし。
受精卵にCRISPR/Cas9などをマイクロインジェクションという方法で注入するのですが、極細のガラスでできた注射針で溶液を入れると考えてもらえるとわかりやすいと思います。受精卵は注入している間も発生していますので、効率よくノックインするためには、どのタイミングで注入するのがいいか、というのがはっきりしていませんでした。
いろんなタイミングでやってみたってことですね。
そういうことです。ポイントは体外受精で作った受精卵を使ったことです。これで受精のタイミングをコントロールできるので、ほぼ同じタイミングで受精した受精卵を集めることができる。それで、培養しつつ、一定時間ごとにCRISPR/Cas9を投与する。
なるほど。それはわかりやすい。
結果として、最適な時期だとノックイン効率が80%、それより”遅い時期”では良くても2%くらいに下がることがわかりました。
ガクンですね。境目がありそうなくらい。
そうなんです。一細胞期胚の終わり頃に起こる核融合の前後が”遅い時期”に当たります。
まだ細胞が一つの受精卵のときの中には、最初は前核という母親由来と父親由来の核がまだそれぞれあって融合していない状態です。それがだんだん近づいていって核融合します。その際に、核膜が一度消えて、一つの核になります。実は、その”遅い時期”というのがこのタイミングなんです。
ほー。
”遅い時期”だと注入したらすぐ核膜がなくなって、せっかく入れたCRISPR/Cas9が細胞質に拡散して濃度が薄まる。それでノックイン効率が悪くなってしまう。
さっき奇しくも僕が言った遭遇確率の話ですね。
たぶんそうだと思います。濃度が濃い方がよく遭遇するんだと思います。それで、ちょっと早い時期に注入すると、この薄まるまで数時間ほど余裕があるので、その間に切断とノックインが起きて、ノックイン確率が高くなる。それ以外にもいろいろ細かい評価も含めて、効率がいいような手法を報告しました。
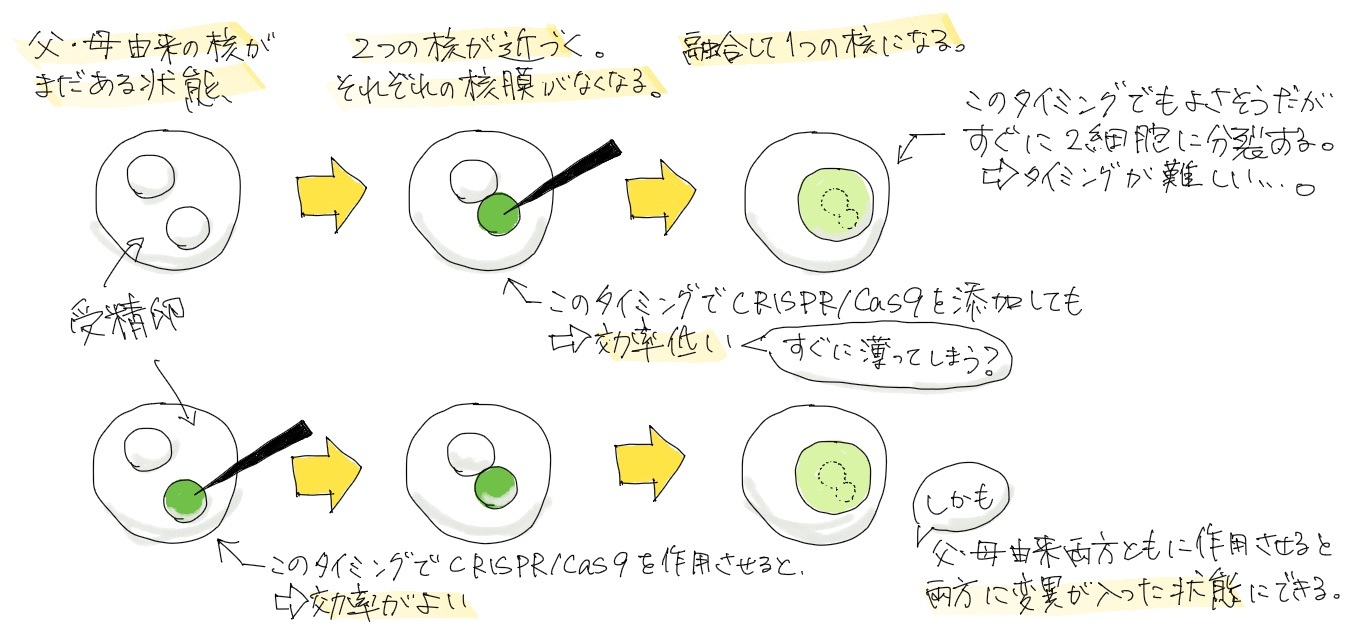
タイミングを測るのが難しく難しそうですね…。
技術的に安定しているというのも非常に重要なんです。僕はインジェクションできませんが、、、
この手の技術の駆け込み寺みたいになっていそう。
技術的な問い合わせはあります。
やっぱり、こういう細かな技術の積み重ねがあって、新しい発見に繋がっていくんですね。

編集後記
ES細胞やCRISPR/Cas9については、解説している書籍やウェブサイトはたくさんあるので、詳しくお知りになりたい方はそちらをご覧ください。1980年代からの遺伝子組み換え技術の歴史があってのゲノム編集なので、調べると面白いと思います。遺伝子組み換えの最初のプロダクトはインシュリンだったはず…。
